Die Integrität der Epithelien und die physiologische Sekretion von Mukus stellen die erste Verteidigungslinie gegen Antigene, Toxine und Mikroorganismen dar. Zudem sezernieren Epithelzellen sowie die Zellen der angeborenen Immunabwehr in Reaktion auf Pathogene antimikrobielle Proteine (AMP).
Der wichtigste Verteidigungsmechanismus gegen opportunistische oder primäre Pathogene wird von jenen Zellen der angeborenen und erworbenen Immunabwehr wahrgenommen, die an mukosale Oberflächen assoziiert und in gut definierten Strukturen organisiert sind. Diese werden als MALT (schleimhautassoziiertes lymphatisches Gewebe/Mucosal-associated Lymphoid Tissues) bezeichnet, z.B. GALT (darmassoziiertes lymphatisches Gewebe/Gut-associated Lymphoid Tissue), PP (Peyer-Plaques), BALT (bronchusassoziiertes lymphatisches Gewebe/Bronchus-associated Lymphoid Tissue), NALT (nasopharyngeal assoziiertes lymphatisches Gewebe/Nasopharyngeal-associated Lymphoid Tissue), etc. Diese Zellen können aber auch im Epithel und in der Lamina propria verstreut vorliegen.

Die Expression von PRRs, hauptsächlich TLRs und NOD-like Rezeptoren (NLRs), auf Epithelzellen und Zellen der angeborenen Immunabwehr moduliert die Erkennung von Mikroorganismen sowie die gegen diese gerichtete Entzündungs- bzw. Immunantwort.
Die Entwicklung der intestinalen mukosalen Immunität beginnt mit der Geburt und erfolgt in Verbindung mit der Kolonisierung des Darms mit Mikrobiota, welche die Reifung des Immunsystems und die Expansion der GALT-Strukturen vorantreibt und das Auftreten von Effektorlymphozytensubpopulationen und an der IgA-Produktion beteiligten B-Zellen beeinflusst. Verschiedene Subpopulationen von CD4-, CD8- und γ-δ-T-Lymphozyten sowie Zellen der angeborenen Immunabwehr sind in der Lamina propria und im Epithel zu finden (Abbildung 1).
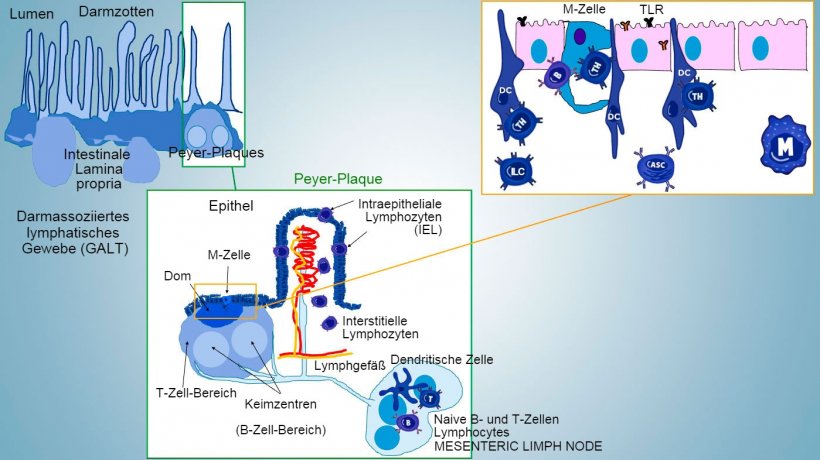
Abbildung 1: Schematische Darstellung des darmassoziierten lymphatischen Gewebes: Peyer-Plaques (PP), isolierte Follikel und Mesenteriallymphknoten.
Die wichtigsten Subpopulationen an T-Helferzellen, deren Differenzierung in der intestinalen Propria erfolgt, sind die regulatorischen T-Zellen (Treg), TH1-, TH2- und TH17-Lymphozyten. Auch die innaten lymphoiden Zellen (ILC) spielen bei der Immunantwort an Barriereoberflächen eine Schlüsselrolle; sie interagieren mit anderen Zellen der angeborenen und erworbenen Immunabwehr, hauptsächlich mit TH17-Zellen.
Zusätzlich hemmt die intestinale Mikrobiota die Besiedlung und Überwucherung mit Pathogenen, indem sie Signale aussendet, die bestimmte innate Mechanismen wie z.B. die Sekretion von antimikrobiellen Proteinen aufrechterhalten.
In der Lunge agieren CD4-, TH1- und zytotoxische CD8-Zellen als Effektorzellen gegen intrazelluläre Pathogene, doch sind auch andere Untergruppen wie TH2-, TH17-, Treg- und TFH-Zellen beteiligt.
Die mukosale Immunität ist in der Lage, zwischen kommensalen Mikroorganismen, Nahrungs- oder Aerosol-Antigenen und primären Pathogenen zu unterscheiden.
Aerosol- und Nahrungsantigene sowie die kommensale Flora stimulieren in der Regel keine Entzündungs-/Immunreaktion, induzieren aber eine Immuntoleranz (Abbildung 2).
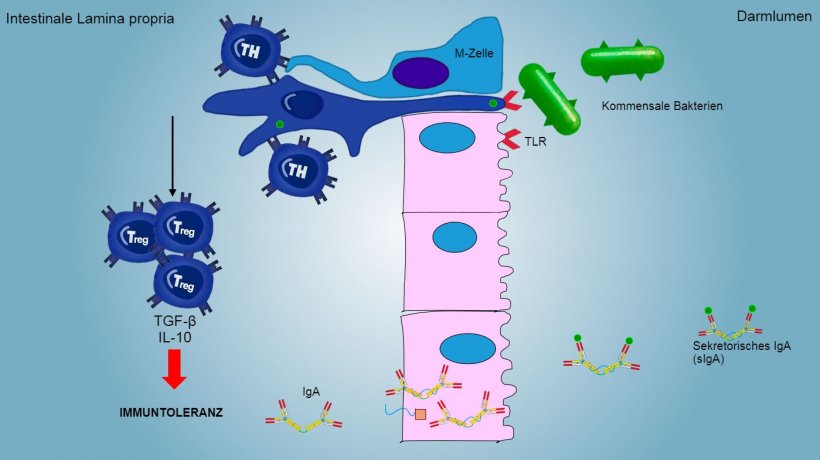
Abbildung 2: Eine Immuntoleranz wird gegen kommensale Bakterien entwickelt. Dies wird durch Treg-Lymphozyten vermittelt und geht mit der Produktion von Zytokinen wie IL-10 und TGF-b einher. Insbesondere im Darm blockiert die Sekretion von spezifischem IgA die Adhäsion von kommensalen Bakterien und moduliert so die Zusammensetzung der Mikrobiota und verhindert gleichzeitig die Invasion und systemische Verbreitung.
Vom funktionellen Standpunkt aus unterscheidet man bei den Immunantworten an Schleimhautoberflächen zwischen sogenannten induktiven Orten und Effektororten:
- Induktive Orte: PP, isolierte Lymphfollikel (ILF), NALT, BALT, Mesenteriallymphknoten (MLN). Reagieren auf Antigene und induzieren die Immunantwort.
- Effektororte: Lamina propria der Darmschleimhaut, obere Atemwege, Urogenitaltrakt, Milch- und Speicheldrüsen. Erzeugen eine Abwehrreaktion und induzieren sowohl eine Entzündungsreaktion als auch eine Antwort der angeborenen und spezifischen Immunabwehr.
An induktiven Orten werden Antigene von Mikrofold (M)-Zellen aufgenommen, die die Antigene intern transportieren und in den extrazellulären Raum freisetzen. Dort werden die Antigene abgefangen und von den darunter liegenden dendritischen Zellen verarbeitet. Dendritische Zellen in der Lamina propria können Antigene auch direkt mithilfe ihrer zytoplasmatischen Fortsätze, die sich zwischen den Enterozyten erstrecken, einfangen.
In den Peyer-Plaques (PP) bewirkt die Antigenpräsentation an die T-Helferzellen, dass die B-Zellen einen Isotypenwechsel in Richtung Produktion und Sekretion von IgA in der Lamina propria und im Darmlumen vornehmen, was einen defensiven Effektormechanismus darstellt (Abbildung 3). Alternativ wandern die antigenbeladenen intestinalen dendritischen Zellen zum Mesenteriallymphknoten und induzieren in der Folge die Aktivierung antigenspezifischer T- und B-Zellen. Danach stellt die Migration der aktivierten B-Lymphozyten die lokale Produktion von IgA sicher und bewirkt eine Reaktion sogar an entfernter Stelle an der Schleimhautoberfläche (Abbildung 4).

Abbildung 3: Produktion von IgA in Peyer-Plaques.


Abbildung 4: Produktion von IgA in den Mesenteriallymphknoten und systemische Reaktion. Proliferierende und aktivierte B- und T-Zellen wandern aus der Lymphe ins Blut aus, bei Schweinen direkt durch die hochendothelialen Venolen (HEV), wobei die Mehrheit in den Darm zurückwandert oder zu anderen Schleimhautoberflächen wie Lunge, Brustdrüse und Urogenitaltrakt gelangt (Effektororte).
In ähnlicher Weise konnte nachgewiesen werden, dass die nasale Immunisierung in der Lage ist, eine Immunantwort sowohl lokal als auch an entfernten Stellen zu bewirken; dies erfolgt durch Migration der Zellen weg vom bronchusassoziierten lymphatischen Gewebe.
An Effektororten variiert die Immunantwort in Abhängigkeit vom zu bekämpfenden Pathogen (Abbildung 5).
Im Fall einer intrazellulären Infektion mit Pathogenen kommt es zu einer TLR- oder NOD-vermittelten Entzündungsreaktion mit nachfolgender Aktivierung der TH1-vermittelten Immunantwort und Aktivierung von NK-Zellen und zytotoxischen T-Lymphozyten, die in der Lage sind, infizierte Zellen abzutöten und zu zerstören. Diese Reaktion könnte mit einer effizienten B-Zell-Aktivierung und der Sekretion von Oberflächenantikörpern in Zusammenhang stehen.
γ-δ-T-Zellen sind an der frühzeitigen Elimination infizierter Zellen oder der Sekretion von AMP sowie der intestinalen Homöostase beteiligt.
Eine TH17-vermittelte Reaktion spielt eine entscheidende Rolle beim Schutz mukosaler Orte gegen hauptsächlich extrazelluläre Bakterien und Pilze, aber auch Viren in der Lamina propria der Darmschleimhaut, wo diese Lymphozyten reichlich vorhanden sind. Während einer Entzündungsreaktion sezernieren die durch IL-23 aktivierten TH17-Lymphozyten IL-17 und IL-22, also jene Zytokine, die die Produktion antibakterieller Peptide sowie die Rekrutierung und Aktivierung der entzündlichen neutrophilen Granulozyten antreiben (Abbildung 5).
In der Lunge erfolgt der Schutz gegen Pathogene mittels Produktion inflammatorischer Zytokine (TNF-a, IL-1β und MIP-1α sowie MIP- 1β) und die Rekrutierung von Neutrophilen, Makrophagen und Lymphozyten wie CD4-T-Zellen, CD8-T-Zellen und γ-δ-T-Zellen.
Die Produktion und Sekretion der sekretorischen IgA-Antikörper stellt ebenfalls einen der Haupteffektormechanismen der mukosalen Immunität dar (Abbildung 6).
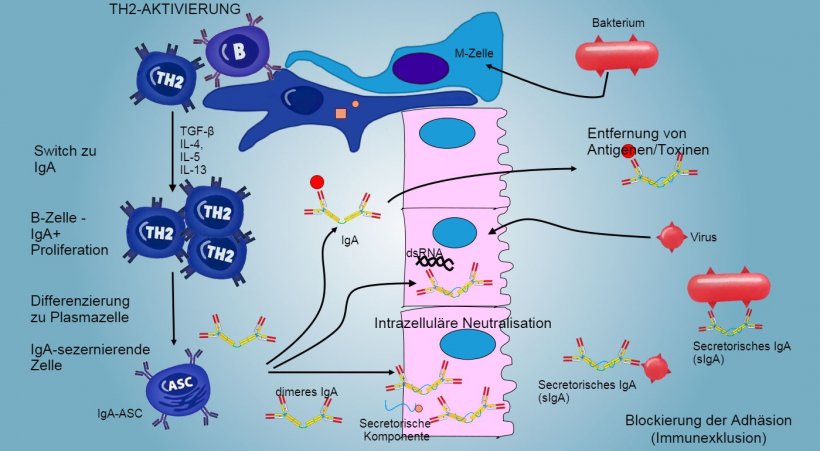
Abbildung 6: Der Switch zu IgA wird hauptsächlich durch Aktivierung der TH2-Lymphozyten gesteuert, wobei es zur Produktion der Zytokine TGF-β, IL-4, IL-5 und IL-13 kommt. Das sezernierte IgA-Dimer bindet an einen Rezeptor (pIgR) an der basalen Oberfläche der Epithelzellen. Der Komplex wird in die Zelle aufgenommen, und noch bevor die Migration durch die luminale Oberfläche erfolgt, wird der Rezeptor gespalten und IgA verbleiben gebunden an den Rezeptorrest (sekretorische Komponente).
IgA herrscht bei allen Oberflächensekretionen sowie bei der mukosalen Sekretion vor; eine gleichbleibende Sekretion von IgA erfolgt durch die in lymphatischem Gewebe oder in der Lamina propria vorhandenen Plasmazellen.
In den intestinalen Peyer-Plaques erzeugt die Aktivierung der B-Lymphozyten IgA-sezernierende Plasmazellen. IgA werden hauptsächlich als IgA-Dimere sezerniert, in denen zwei Monomere durch eine J-Kette verbunden und an eine sekretorische Komponente gebunden werden, die das sIgA vor der Wirkung der proteolytischen Enzyme im Darm schützt. IgA verhindern das Anhaften von Viren und Bakterien an die Epithelzellen (Immunexklusion) und sind in der Lage, virale Proteine innerhalb der Zelle zu binden und die Replikation der Viren zu blockieren (intrazelluläre Neutralisation); zudem können sie in die Mukosa eingedrungene Antigene binden und sie durch das Epithel abtransportieren, um sie so aus dem Lumen zu entfernen (Antigenentfernung).
Der Isotyp-Switch zu IgA wird hauptsächlich durch die Aktivierung der TH2-Lymphozyten und die Produktion der Zytokine TGF-β, IL-4, IL-5 und IL-13 gesteuert. Das sezernierte IgA-Dimer bindet an einen Rezeptor (pIgR) an der basalen Oberfläche der Epithelzellen. Der Komplex wird in die Zelle aufgenommen, und noch bevor die Migration durch die luminale Oberfläche erfolgt, wird der Rezeptor gespalten und IgA verbleiben gebunden an den Rezeptorrest (sekretorische Komponente).
Im Atmungstrakt herrscht in den oberen Abschnitten (Nasenhöhlen, Pharynx, Larynx, Trachea, Bronchus) IgA vor, während in den unteren Abschnitten (Bronchien, Alveolen) eine vorwiegend systemische Immunantwort erfolgt, an der die tributären Lymphknoten sowie die vorherrschende Sekretion von IgG beteiligt sind.






